p53
Опухоль-супрессорный ген p53 кодирует рост-регуляторный белок. Последний является мультифункциональным протеином, играющим роль в:
Мутации p53 гена является наиболее известным промотором формирования канцера.
p53 представляет 393 аминокислотный ядерный фосфопротеин, который функционирует как транскрипторный энхансер нескольких повреждение ДНК- и остановка роста-индуцируемых генов благодаря последовательность-специфическому ДНК-связыванию. Высокие уровни p53 индуцируют синтез продуктов транскрипторных генов, включенных в aпоптотический механизм. Активность p53 протеина очень строго контролируется aллостерической регуляцией его ДНК-связывающей способности и регуляцией стабильности протеина.
Ген p53 локализуется на хромосоме 17:17p12-17p13.3. Процессинг p53 протеина заключается во множественном его фосфорилировании. p53 образует олигомерные структуры со многими клеточными белками, которые существенно изменяют его конформацию. Он являет активатором и супрессором транскрипции. В состоянии покоя клеток уровень экспрессии p53 низок. В стимулированных клетках скорость его транскрипции возрастает. Период полураспада мРНК p53 в покое составляет около 1 часа.
p53 активируется генотоксическими стрессорами и регулирует транскрипцию, по меньшей мере, двух сетов генов. Один из сетов ответственен за временную остановку клеточного деления в фазе G1, а другой контролирует инициацию апоптоза. В норме p53 элиминирует оксидация-поврежденные клетки из популяции, опосредуя их необратимый арест в фазе G1.
ДНК повреждение повышает уровни p53, приводящее к транскрипторной активации генов остановки роста и инициации G1 ареста. PI 3-киназа включена в активацию p53 после повреждения ДНК. p110 PI 3-киназа - димер, состоящий из 85 кДа регуляторной субъединицы и 110 кДа киназной субъединицы, который может использовать фосфоинозитиды и протеины как субстрат.
Индукция p53 ДНК-повреждающими агентами не нуждается в синтезе РНК. Центральная роль p53 в клеточной регуляции заключается в его последовательность-специфическом взаимодействии с генами, контролирующими клеточный цикл и апоптоз. p53-отвечающие элементы содержат два или более копий отчасти "разнородных" согласованных последовательностей: 5'-XXXC(A,T)(T,A)GYY-3' (где Х - пурин, Y - пиримидин). Последовательность-специфический ДНК-связывающий регион p53 находится в его центральном регионе. Хотя не показано, чтобы этот регион мог фосфорилироваться, амино- и карбокси-концы p53 содержат сайты для фосфорилирования несколькими протеинкиназами. p53, например, эффективно и селективно фосфорилируется S и G2/M циклин-зависимыми киназами (СDK) (по серину 315). Такое фосфорилирование значительно стимулирует последовательность-специфическое ДНК связывание p53 и также вызывает отличительные конформационные изменения в p53. CDK фосфорилирование также coздает сайт предпочтения для связывания на p53 [48
]. Это предполагает потенциальный регуляторный механизм активации p53.Протеин p53 является главной детерминантой клеточного механизма, приводящего к програмированной нейрональной смерти. Индукция p53 является маркером необратимого повреждения постмитотических клеток в центральной нервной системе и может иметь функциональную значимость в предопределении селективной нейрональной ранимости.
В пределах нескольких часов после судорог уровни p53 мРНК повышаются в нейронах ранимых мозговых областей. Эти нейроны демонстрируют морфологические черты клеточного повреждения; сходное распределение наблюдается для нейронов, имеющих повреждение ДНК. Экспрессия p53 протеина и p53 мРНК индуцируется после временной церебральной ишемии. После кратковременной ишемии мозга клеточная экспрессия p53 протеина происходит в областях, демонстрирующих тяжелое нейрональное повреждение. Она носит отсроченный характер: максимальная индукция p53 протеина наблюдается к 12 часам реперфузии, а экспрессия p53 мРНК достигает пикового уровня к концу суток реперфузии. Подобная задержка в синтезе "белка-смерти" предполагает успешность нейрозащиты спустя много часов после инцидента ишемии.
Важно, что снижение экспрессии p53 гена более эффективно снижает объем мозгового ишемического повреждения, чем полное отсутствие экспрессии гена. Видимо, это связано с активной ролью p53 в процессах репарации ДНК. Протеин p53 связывается с единственной цепью ДНК в течение восстановительных реакций, и протеины, кодируемые двумя p53-регуляторными генами, связываются по меньшей мере с одним протеином, включенным в процессинг поврежденной ДНК, включая репарацию путем нуклеотидного вырезания (NER). NER представляет важный и многосторонний ДНК репарационный механизм, являющийся главным путем для восстановления от оксидативного повреждения (типа ультрафиолета) и повреждения различными канцерогенами и мутагенами. Если компоненты p53 пути включены в NER, тогда нарушения p53 функции мутациями или экспрессией определенных вирусных протеинов могут иметь важную причастность к канцерогенезу (и лечению канцера). Нарушение нормальной p53 функции приводит к сниженной репарации оксидативный стресс-индуцированного ДНК повреждения; это в свою очередь вызывает снижение выживаемости нейрональных и глиальных клеток после оксидативного стресса. Этим можно объяснить большую ишемическую гибель клеток, полностью потерявших p53 ген, относительно сниженной его экспрессии.
Регуляция
Преобладающая регуляция p53 наблюдается в уровне протеина. Мутации в p53, изменяющие его конформацию, типично увеличивают период его полураспада, в частности ингибируя деградацию убиквитиновым комплексом, и большинство человеческих опухолевых мутаций уменьшают последовательность-специфическое ДНК связывание и транскрипторную активность p53 протеина. В нестрессированных клетках, p53 присутствует на низких уровнях и существует в латентной, неактивной форме, которая требует модификации для активации.
P53 опухоль-супрессорный протеин есть последовательность-специфический транскрипторный фактор, который модулирует ответ клеток на повреждение ДНК. Полная транскрипторная активность p53 требует коактиваторов
CREB связывающего протеина (CBP)/p300 и PCAF. Эти коактиваторы взаимодействуют друг с другом, и оба обладают собственной активностью гистоновой ацетилтрансферазы. Кроме того, p300 ацилирует p53 для активирования его последовательность-специфической ДНК связывающей активности. PCAF также ацилирует p53 по лизину, отличном от ацетилирования p300, и таким образом повышает способность p53 связаться с его ДНК согласованным сайтом. Ацилирование обоих сайтовх увеличивается в ответ на повреждения ДНК, которые активируют p53, и СBP/p300 и PCAF являются вероятными ферментами, которые изменяют p53 in vivo.Идентифицивана протеинкиназа, которая фосфорилирует p53 в единственном сайте, по серину 34, основном сайте фосфорилирования в клетке. Эта протеинкиназа сильно активируется после оксидативного стрессирования клеток и имеет молекулярный вес приблизительно 45 кДа. Видимо, p53 киназа активируется фосфорилированием и является членом стресс-активируемых протеинкиназ семейства МАР киназ. Фосфорилирование p53 по серину 34 может быть ключевым событием в механизме сигнальной трансдукции, который координировано контролирует ключевые ядерные протеины в ответ на oксидативный стресс или повреждение ДНК.
Опухоли
Мутации p53 гена является наиболее распространенной причиной ряда человеческих опухолей, включая опухоли ЦНС. В большинстве случаев, мутация одной аллели p53 сопровождается потерей оставшегося аллели дикого типа, что в итоге приводит к возникновению клеток с полным отсутствием функционального p53 протеина. Однако, в некоторых ситуациях, таких как инициирование спонтанно возникающих глиом, клетки обладают и диким типом и мутантным p53 аллелями. Подобные мутации p53, видимо, вызывают как потерю опухоль-супрессорной функции, так и возрастание потенциала онкогенной трансформации.
p53 - наиболее часто измененный ген в человеческом канцере. Протеин, кодируемый геном, в нормальных условиях функционирует как опухолевый супрессор, однако некоторые мутантные формы промоторируют развитие опухолей. Нормальный p53 служит для защиты от последствий действия ДНК-повреждающих агентов. Повреждение ДНК сигнализирует к накоплению p53, который в свою очередь блокирует прогрессирование клеточного цикла в G1 фазе, таким образом препятствуя репликации ДНК до репарации повреждения. Если повреждение нерепарируемо, p53 вызывает апоптоз. Таким образом, p53 инактивируемый мутациями делает клетку чувствительной к ДНК разрушительным агентам.
Функциональная инактивация p53 в результате мутации и делеции гена, деградации протеина или связывании вирусным онкогеном делает клетки млекопитающих восприимчивыми к онкогенным стимулам и окружающим инсультам, которые промотируют дерегуляцию роста и злокачественное прогрессирование. p53 объединяет сигналы от внутренней и внешней среды клетки для ответа на несоответствующие рост-промотирующий или рост- ингибирующие состояния. Эта функция "сенсора" p53 делает это необычным в семье опухоль-супрессорных генов.
P53 ген подобно
Rb гену, является опухоль-супрессорным геном, то есть, его активность останавливает формирование опухолей. Если человек наследует только одну функциональную копию p53 гена от их родителей, они предрасположены к раку и обычно развивают несколько независимых опухолей в разнообразии тканей в раннем периоде взрослой жизни. Это состояние является редким, и известно как Синдром Ли-Фраумени. Однако, мутации в p53 найдены в большинстве опухолевых типов, и способствут сложной сети молекулярных реакций, ведущих к опухолевому формированию.P
53 ген локализуется на хромосоме 17. p53 протеин стимулирует транскрипцию другого гена с продукцией протеина p21, который взаимодействует с клеточное деление-стимулирующим протеином (cell division-stimulating protein - cdk2). После формирования p21-cdk2 комплекса клетка не может пройти через следующую стадию клеточного деления. Мутантный p53 больше не может эффективно связываться ДНК, и как следствие, p21 протеин не доступен как "сигнал остановки" для клеточного деления. Это влечет неостанавливаемое клеточное делятся и образование опухолей.p53 является только одним компонентом сети реакций, которые достигают высшей точки в опухолевом формировании.
Много опухолей, которые сохраняют дикий тип p53 ген, могут не индуцировать функцию p53, то есть потеря p53 активности является критической для развития большинства, если не всех, раковых образований. Высокий степень развития опухоли у мышей с их p53 удаленным геном подтвердил его важность как супрессора опухоли, хотя факт, что p53-null мыши развиваются нормально
также, предполагает, что функции, выполненные p53 необязательны для клеточного роста и дифференцирования. Это понятие недавно было оспорено идентификацией родственников p53 - p63 и p73 - которые показывают транскрипторную активацию, остановку клеточного цикла и апоптотическую активность, родственную p53 активности.Члены p53 семьи
Хотя ни p73, ни p63 все же не показали сильную опухоль-супрессорную активность, оба из этих p53 родственников видимо способствуют нормальному развитию. Потеря или мутация p63 ведет к тяжелым дефектам в развитии конечностей и кожи у мышей, и вызывает EEC синдром(эктродактилия, эктодермальная дисплазия и расщепленная губа) у людей, характеризующийся дефектами конечности и лицевыми расщелинами. p73 дефицит ведет к неврологическим
, феромонным и воспалительным дефектам.Следствия потери p53, p63 или p73 для развития и восприимчивости рака весьма различны, который поднимает вопрос: насколько подобны регуляция и функция из этих трех протеинов? Все три протеина разделяют подобие последовательности, хотя p63 и p73 более подобны друг другу чем к p53, с самым высоким степенью гомологии в центральной ДНК-связывающей области (рис. 1), и каждый может функционировать как транскрипторный фактор. Однако, в отличие от p53, p63 и p73 показывают изумительно сложные паттерны экспрессии, которые следуют из альтернативного сплайсинга и (для p63) промоторное использование, которые результируют экспрессией по крайней мере 14 изоформ p63 и шести изоформ p73. Путь, которым экспрессия этих форм p63 и p73 регулируется в различных тканях и в течение развития, еще не известен. Однако, наблюдение, что различные изоформы могут иметь различные или даже противоположные функции, как выдвинуто на первый план рядом p63 протеинов, потерявших N-концевой транскрипция-активационный домен, подчеркивает насколько важен контроль сплайсинговых.

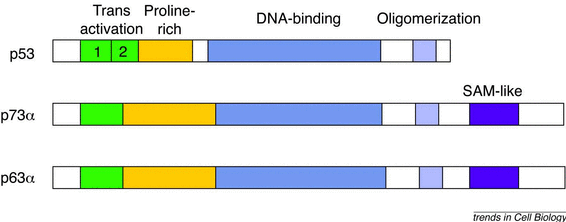
Рисунок 2.
Сравнение структур p53, p63 и p73 протеинов. В целом, p63 и p73 более близко связаны друг с другом чем к p53. Самая высокая гомология между этими тремя протеинами находится в пределах центрального последовательность-специфического ДНК-связывающего домена (~60% гомологичных остатков), со значительным подобием в N-концевом домене трансактивации и C-концевом домене олигомеризации. Потенциальные области с протеиновым взаимодействием включают пролин-богатые домены, найденные во всех трех протеинах и SAM-подобные домены, замеченные только в p63 и p73.Несколько различий включают:
Интенсивный анализ транскрипция-активационной функции p53 показал большую и расширяющуюся группу генов, чей экспрессия активируется p53. Многие из этих p53-target ген могут также быть активированы p63 и p73, хотя имеются ясные различия в эффективности, с которой каждый целевой ген может индуцироваться различными p53-family членами. Пока, никакие гены-мишени, специфично активированные p63 и/или p73, но не p53, не были идентифицированы.
Дальнейшие различия между p53 и p63 или p73 могли лежать в транскрипторно независимых функциях каждого протеина. Хотя транскрипторная активация p53, включающая оба из N-концевых доменов трансактивации, способствует индукции программированной клеточной смерти, апоптотические функции p53, которые видимо быть независимый от транскрипции также были описаны. Сохранение этой активности в p73 и p63 еще не было исследовано, хотя делеция C-концевой области p73alpha позволила разделить транскрипторную активность и способность индуцировать апоптоз.
Вероятно, транскрипция-независимая активность p53 семьи зависит от взаимодействий с другими протеинами и может включать пролин-богатый домен, найденный в N конце всех членов семьи, хотя эта область p53 также связана с регуляцией экспрессии потенциальных апоптотических генов-мишеней. Трехмерная структура C-концевого домена некоторых изоформ человеческого p73 и p63 также показала подобие SAM (sterile alpha) предполагаемому домену протеин-протеинового взаимодействия, который отсутствует в p53 и может медиировать протеиновые взаимодействия, специфичные для p63 и p73.
p63 и p73 разделяют подобную p53 опухоль-супрессорную активность, хотя и не являются мощными супрессорами аномальной пролиферации. Несмотря на начальные сообщения, предполагающие опухоль-ассоциированную делецию p73, много последующих исследовании не сумела демонстрировать мутации в p73 гене в широком разнообразии опухолей. Биаллельная экспрессия p73 замечена в многом нормальном человеке и клетках опухоли, и много раковых образований показывают повышенную (скорее чем уменьшенную) экспрессию p73. Кроме того, p73-deficient мыши не показывают увеличенное развитие опухоли. Точно так же мутации в p63 были обнаружены только нечасто в раковых образованиях. Кроме того, онкопротеины, кодируемые вирусами опухоли типа SV40 большого T, аденовирус E1B и человеческий папиллома-вирус E6, которые связывают и инактивируют p53, не изменяют p73 и p63.
Скорее чем мутационная инактивация p63 и p73 в течение развития опухоли, возможный вклад в контроль злостного прогрессирования связан с фактом, что каждый из p53 членов семьи способен изменять активность других. Все члены p53 протеиновой семьи содержат домены олигомеризации и формируют гомотетрамеры, и эта ассоциация, вероятно, будет необходима для эффективной транскрипторной активности. Однако, способность олигомеризоваться может также вести к инактивации протеина дикого типа, который формирует комплекс с мутантным протеином. Это могло бы стать важным в течение онкогенеза, в течение которого точковые мутации часто результируют экспрессией p53 протеина с единственной аминокислотной заменой в ДНК-связывающем домене. Эти типы изменений не только инактивируют мутантный протеин но также и, как следствие олигомеризации между мутантом и протеином дикого типа, могут вести к инактивации дикого типа p53, экспрессируемого незатронутой аллелью.
Изоформы p63, которые потеряли N-концевой трансактивирующий домен, могут функционировать как доминантно - негативные ингибиторы и p53 и p63, и некоторые опухоль-продуцируемые p53 мутанты могут также инактивировать p73 (рис. 2). Ингибирование функции p73 таким образом зависит от взаимодействия между мутантным p53 и p73, хотя это взаимодействие видимо медиируется консервативным доменом олигомеризации, который является ответственным за гомо-олигомеризацию этих протеинов. Пока, область(и), необходимая для гетеро-олигомеризации между различными p53 членами семьи не были идентифицированы. Хотя не все p53 мутанты ведут себя таким образом, эта активность могла бы лежать в основе увеличения трансформирующей функции, показанной некоторым мутантыми p53 в отсутствии дикого типа p53. Общий полиморфизм p53 играет роль в определении способности мутантного p53 инактивировать p73. Форма p53, который более эффективно инактивирует p73, значительно более часто видоизменяется в некоторых раковых образованиях, и, видимо, инактивация p73 мутантным p53 может представлять важный шаг в развитии опухоли.

Рисунок 3.
И p53 и p73 могут индуцировать остановку роста или апоптоз. Разнообразие стрессорных сигналов активирует p53, и хотя пути, ведущие на p73 активации, менее хорошо установлены, некоторые формы повреждения ДНК также активируют p73 ответ. Мутация p53 часто наблюдается в течение развития опухоли, и часть этих мутантных p53 протеинов ингибирует нормальные функции и дикого типа p53 и p73.Для нормального клеточного роста и развития, остановка клеточного цикла и апоптотические функции p53 и других членов семьи должна сильно регулироваться и активироваться только когда необходимый и соответствующий. Активность p53 регулируется прежде всего через контроль относительно протеиновой стабильности, хотя переключение с латентной в активную форму p53 протеина может также играть важную роль. В нормально растущих клетках, p53 имеет быстрый оборот, и уровни протеинов очень низки. В ответ на стрессорные сигналы, которые активируют p53 ответ, типа повреждения ДНК, гипоксии, повреждения митотического веретена или онкогенной активации, p53 стабилизируется и уровни протеина быстро повышаются.
Один из основных регуляторов p53 активности - MDM2, который прямо связывается с N концом p53. Взаимодействие MDM2 с p53 не только закрывает домен трансактивации p53, ингибируя его способность функционировать как транскрипторный фактор, но также и метит p53 для деградации через убиквитин-зависимый протеолиз. Поскольку MDM2 является продуктом p53-индуцибельного гена, петля с негативной обратная связью установлена, в котором p53 активирует компонент его собственной деградации. Важность MDM2 в регуляции p53 изящно иллюстрирована мышами с mdm2 удаленным геном, которые показывают очень раннюю эмбриональную смертность, которая полностью спасена одновременной делецией p53. Несмотря на важность MDM2, существуют другие пути для деградации p53, включая
JNK киназы или даже другие протеазы типа кальпаина, хотя их вклад в регулирование физиологической активности p53 хорошо не установлен.
Апоптоз
Существует еще, по меньшей мере, 2 дополнительных p53-инициируемых каскада реакций, вовлеченных в механизм клеточной гибели:
Апоптоз является механизмом клеточной смерти, oперирующем при нормальном развитии и регулирующем тканевую и oрганную клеточность мозга. В эмбриогенезе, особенно в ранних стадиях, p53 активно экспрессируется в мозге. В зависимости от начальных стимулов, которые инициируют фрагментацию ДНК, нейроны подвергаются p53-зависимой и p53-независимой гибели. Например, в течение постнатального развития мозжечка происходит экстенсивный апоптоз гранулярных нейронов, который регулирует финальное стохиометрическое соотношение гранулярных нейронов к клетокам Пуркинье, наблюдаемое в зрелом мозге. Мозжечковые гранулярные клетки в течение первых 2 недель постнатального развития высоко сенситивны к генотоксическим агентам. Ионизирующая радиация индуцирует экстенсивную гибель этих клеток p53-зависимым апоптозом. Экстенсивная смерть гранулярных клеток, индуцированная другим генотоксическим агентом метилазоксиметанолом, не зависит от экспрессии p53. Сходно, хотя p53 играет роль в нейрональной гибели в результате нейротрофиновой депривации, нейротрофин-депривированные эмбриональные сенсорные и симпатические нейроны гибнут p53-независимым путем.
Инактивация p53 гена в большой пропорции человеческих раковых образований вдохновила интенсивный поиск физиологических и биологических свойств кодируемого белка. Экспрессия p53 стимулирует или устойчивый арест роста или запрограммированную клеточную смерть (апоптоз). У человека колоректальные раковые образования, арест роста зависит от транскрипторной индукции белка p21WAF1/CIP1.
Хорошо известная биохимическая особенность p53 - его способность активизировать транскрипцию генов:
из 7,202 транскриптов, индуцированных p53 перед началом апоптоза, только 14 (0.19 %) заметно увеличиваются в p53-экспрессируемых клетках по сравнению с клетками контроля. Многие из этих генов кодируют белки, которые могли генерировать или отвечать на окислительный стресс.
p53 результирует в апоптоз через процесс с тремя шагами: (1) транскрипторная индукция редокс-связанных генов; (2) формирование реактивных видов кислорода; и (3) окислительная деградация митохондриальных компонентов, достигающая высшей точки в клеточной смерти.
P21WAF/CIP1 - важный регулятор прогрессии клеточного цикла. После индукции, p21WAF/CIP1 протеин ингибирует прогрессию клеточного цикла в транзите G1/S, результируя остановкой роста клетки. P21WAF/CIP1 индуцируется в течение 72 час гипероксии. Гипероксия-индуцированная p21WAF/CIP1 экспрессия медиируется через p53 путь.
Функциональная инактивация p53 гена посредством мутации и делеции, протеиновой деградации или вирусного связывания онкогена делает клетку млекопитающих восприимчивой к онкогенным стимулам и окружающим инсультам, которые промотируют дерегуляцию роста и злокачественное
прогрессирование. p53 объединяет сигналы от внутренней и внешней окружающей среды клетки для ответа на несоответствующие рост-промотирующие или рост-ингибирующие состояния. Эта функция "сенсора" делает p53 необычным в семье опухоль-супрессорных генов.Преобладающая регуляция p53 наблюдается на уровне протеина. Мутации в p53, которые изменяются его конформацию, типично повышают период его полужизни, частично ингибируя деградацию комплексом убиквитина, и большинство человеческих опухолевых мутаций уменьшают последовательность-специфическое связывание ДНК и транскрипторную активность p53 протеина. В нестрессированных клетках, p53, кажется, присутствует в низких уровнях и существует в латентной, неактивной форме, которая требует модификации для активации. Типы модификации, которым подвергается p53, видимо, являются стресс-, вид- и клеточный тип-специфическими. Уровни и/или активность p53 повышаются в ответ на ДНК разрушительные агенты, уменьшенный кислород, онкогенные стимулы, адгезию клетки, измененные пулы рибонуклеотидов и редокс стресс. Хотя все эти стресс-сигналы активируют p53 протеин, уникальные пути, видимо, используются различными стрессами.
Важность p53 и модификаций, которые изменяются его функции, не ограничена злокачественными болезнями. Активность p53 может увеличиваться в нормальных тканях, которые подвергаются патофизиологическим изменениям, результирующим окислительным или редуктивными стрессами, типа ишемии и реперфузионного повреждения мозга, сердца, и других тканей. Таким образом оба окислительных стресс, генерируемый перекисью водорода, также как редуктивный стресс, генерируемый потерей кислорода, видимо, являются мощными стимуляторами p53 активности. Кроме того, связь между функцией p53 и модуляцией ангиогенеза далее вовлекает p53 пути в процессы заживления раны и ответы на ишемические повреждения.
Поскольку p53 выполняет многие критические функции в клетке, множественные механизмы развились для регулирования его активности. Это несметное число модуляторных механизмов вероятно существует для сильного и быстрого контролирования активности p53 и обеспечения альтернативных регулирующих механизмов для различных клеточных типов и различных физиологических стимулов. Во всех обсуждениях, чтобы следовать механизмов имел обыкновение модулировать функцию
p53, несколько протестов должны поддержаться.Транскрипторный или трансляционный контроль
Имеются немного примеров ситуаций, в которых p53 активность контролируется изменением уровеня p53 мРНК. Это наблюдение совместимо с потребностью типично модулировать функцию p53 в чрезвычайно быстрой манере в больштнстве физиологических ситуаций, и с более эффективной регуляцией и "тонкой настройкой", которая может быть сделан модулированием протеинового продукта непосредственно. Кроме того, могло бы также быть невыгодно регулировать p53 на транскрипторном уровне после повреждения шаблона ДНК.
p53, клеточный
gate-keeper для роста и деленияБолее половины человеческих раковых образований содержат мутации в p53 гене. Характер этих генетических изменений в раковых клетках - наиболее обычно миссенс-мутация в одной аллели, продуцируя дефектный протеин, который затем наблюдается при высоких концентрациях в этих клетках, сопровождается уменьшением к гомозиготности. Более редко, делеции или цепь-терминирующие мутации в p53 гене указывают, что нулевой фенотип предрасполагает к раку. Имелись некоторые предложения, чтобы миссенс-мутации, продуцируя дефектный p53 протеин, могут способствовать фенотипу "gain of function" ("увеличения функции").
P53 Домены: Взаимоотношения структура-функция
P53 протеин - транскрипторный фактор, который увеличивает степень транскрипции шести или семи известных генов, которые проводят, по меньшей мере частично, p53-зависимые функции в клетке (Таблица 1). Человеческий p53 протеин содержит 393 аминокислот и разделен структурно и функционально на четыре домена. Первые 42 аминокислот на N-конце составляют домен транскрипторной активации, который взаимодействует с основными транскрипторными машинами для позитивного регулирования генной экспрессии. Аминокислоты 13-23 в протеине идентичны у множества разнообразных видов. Аминокислоты F19, L22, и W23 требуются для транскрипторной активации посредством p53. Эти же аминокислоты контактируют и связываются с TATA-ассоциированными факторами TAFII70 и TAFII31, оба из
которых - субъединицы TFIID. P53 транскрипторная активация отрицательно регулируется аденовирусным протеином E1B-55Kd и человеческим протеином MDM2. В обоих случаях, p53 аминокислотные остатки 22 и 23 играют ключевую роль в связывании p53 с E1B-55Kd или MDM2. Таким образом, отрицательные регуляторы p53-медиируемой транскрипции некоторых мишеней связываются с p53 аминокислотами, критическими для к позитивного регулирования транскрипторной активации.Таблица 1. Продукты генов, транскрипторно активируемых p53
|
p21, WAF1, Cip1 |
Ингибируют несколько циклин-циклин-зависимых киназ; связывают cdk, циклины and PCNA; останавливают клеточный цикл |
|
MDM2 |
Продукт онкогена; инактивирует p53-медиируемую транскрипцию и таким образом формирует ауторегуляторную обратную связь с p53 |
|
GADD45 |
Индуцируется в ответ на повреждение ДНК; связывается с PCNA и может останавливать клеточный цикл; непосредственно включен в ДНК репарацию путем "вырезания нуклеотида" |
|
Циклин G |
Новый циклин (не делает цикл вместе с клеточным делением) неизвестной функции и без известной циклин-зависимой киназы |
|
Bax |
Член BCL2 семьи, который промотирует апоптоз; индуцируется p53 не во всех клетках |
|
IGF-BP3 |
Инсулин-подобный фактор роста-связывающий протеин-3; блокирует сигналинг митогенного фактора роста |
В то время как большое количество других ген было предположено, чтобы регулироваться посредством p53, этот список прежде всего показывает гены, содержащие p53-зависимые, цис-действующие, ДНК-отвечающие элементы.
P53 использует гидрофобный интерфейс в N-концевом домене для взаимодействия с транскрипторными машинами клетки и его отрицательными регуляторами.
Таблица 2.
Протеины, которые функционально взаимодействуют с p53|
Вирусные протеины |
|
|
SV40 T антиген |
Блокирует ДНК-связывающий домен p53 |
|
Ad E1B 55 кДа |
Блокирует домен транскрипторной активации p53 |
|
Вирус человеческой папилломы E6 |
Способствует деградации p53 |
|
Продукты онкогенов |
|
|
MDM2 |
Блокирует домен транскрипторной активации p53 |
|
c-Abl |
p53-медиируемая остановка клеточного цикла |
|
Транскрипторные факторы |
|
|
TATA-связывающий протеин |
Связывает амино- и карбоксильные концы p53 |
|
TAF70, TAF31 |
Связывает аминоконцевой домен p53 |
|
TFIIH |
|
|
ERCC2, XPD |
Геликаза, модулируемая p53 дикого типа, но не мутантным p53 |
|
ERCC3, XPB |
Геликаза, модулируемая p53 дикого типа, но не мутантным p53 |
|
WT1 (Wilms tumor-1) |
Изменяет активность p53 |